|
การพัฒนากระบวนการสังเคราะห์สารเคมีโดย “เคมีสีเขียว” [1,3] เป็นวิธีการที่กำลังเป็นที่ศึกษาอย่างมากในต่างประเทศ เพื่อลดขั้นตอนในการใช้ตัวทำละลายอินทรีย์ในห้องปฏิบัติการ และสอดคล้องกับหลักการ “เคมีสีเขียว” ดังที่เคยกล่าวมาแล้ว [3] ตามกฎข้อที่ 3 การออกแบบกระบวนการสังเคราะห์ที่ไม่เป็นอันตราย (Design less hazardous chemical syntheses) และกฎข้อที่ 8 ใช้ตัวทำละลายและกระบวนการที่ปลอดภัย (Use safer solvents and reaction conditions) ตัวทำละลายที่ปลอดภัยและเป็นมิตรต่อสิ่งแวดล้อมที่ใช้ในปฏิกิริยาทางเคมีมีหลายชนิดได้แก่ น้ำ คาร์บอนไดออกไซด์เหลว (supercritical CO2) และ ตัวทำละลายมีประจุ (ionic liquids) ในขณะที่ตัวทำละลายอินทรีย์ส่วนมากไม่เป็นมิตรต่อสิ่งแวดล้อม อย่างไรก็ตาม การห้ามใช้ตัวทำละลายอินทรีย์เป็นสิ่งที่มีความยุ่งยากในห้องปฏิบัติการทางเคมี การเลือกใช้ตัวทำละลายสีเขียวในปฏิกิริยาเคมีจึงเริ่มถูกพิจารณามากขึ้น ในกระบวนการผลิตของห้องห้องปฏิบัติการเภสัชเคมีและบริษัทผู้ผลิตยา เช่น Pfizer [4] บนพื้นฐานของ Environmental Health และ Safety (EHS) ได้แก่
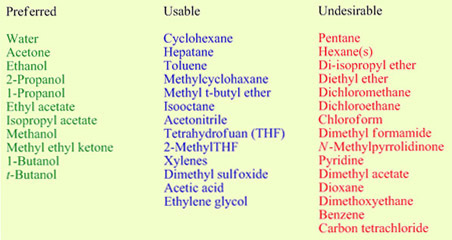
การแบ่งชนิดของตัวทำละลายตามหลักการดังกล่าว ซึ่งครอบคลุมชนิดของตัวทำละลายที่ถูกใช้ ในห้องปฏิบัติการเภสัชเคมีเกือบทั้งหมด โดยแบ่งกลุ่มตัวทำละลายเป็น 3 กลุ่มตามแถบสีแสดงดังรูปที่ 1 ได้แก่ กลุ่มที่ถูกแนะนำให้ใช้ Preferred (สีเขียว) กลุ่มที่สามารถใช้ได้ Usable (สีน้ำเงิน) และกลุ่มที่ไม่แนะนำให้ใช้ Undesirable (สีแดง) [4]
Figure 1. Pfizer solvent selection guide for medicinal chemistry [4] ตัวทำละลายสีแดงหลายชนิดมีจุดวาบไฟต่ำ มีความเป็นพิษสูง และเป็นสารก่อมะเร็ง หลายชนิดจัดเป็น Hazardous airborne pollutant (HAP) ควรหลีกเลี่ยงหรือห้ามใช้ในประเทศสหรัฐอเมริกาและกลุ่มประเทศยุโรป อย่างไรก็ตาม เพื่อลดปัญหาทางจิตวิทยาต่อนักวิจัย ในการห้ามใช้ “Don’t use” ตัวทำละลาย จึงมีการกำหนดตารางการเลือกใช้ “Use this instead” สำหรับตัวทำละลายทางเลือก (alternative solvents) [4] Table 1. การเลือกใช้ตัวทำละลาย (Solvent replacement) [4]
นอกจาก benzene และ carbon tetrachloride ที่ถูกผลักดันให้ยกเลิกการใช้และให้ใช้ตัวทำละลายทางเลือกแล้ว ตัวทำละลายทางเลือกสวนใหญ่จะมีคุณสมบัติทางเคมีหรือบทบาทหน้าที่ที่ใกล้เคียงกัน เช่น heptanes มีจุดวาบไฟที่สูงกว่า pentane จึงลดความเสี่ยงได้มากกว่า อย่างไรก็ตาม ย ังมีข้อโต้เถียงในประเด็นการเลือกใช้ตัวทำละลายที่มีคลอรีนเป็นองค์ประกอบ (chlorinated solvent) อยู่บ้าง แต่ก็มีการอนุโลมให้ใช้ dichloromethane แทน chlorinated solvent อื่นๆ เช่น chloroform ในขั้นตอนการทำปฏิกิริยา ในขณะที่ EtOAc MTBE และ 2-MeTHF สามารถใช้เป็นทางเลือกแทนการใช้ dichloromethane ในขั้นตอนการสกัดสาร เป็นต้น การวิจัยและศึกษาพัฒนาองค์ความรู้ใหม่เพื่อการสังเคราะห์สารที่มีฤทธิ์ทางยาที่ห้องปฏิบัติการเภสัชเคมี สถาบันวิจัยจุฬาภรณ์และโครงการบัณฑิตศึกษา สาขาเคมีชีวภาพ สถาบันบัณฑิตศึกษาจุฬาภรณ์ ให้ความสำคัญโดยคำนึงถึงการใช้ตัวทำละลายสีเขียวที่เป็นมิตรต่อสิ่งแวดล้อมและเป็นทางเลือกในปฏิกิริยาเคมี “น้ำ” [5,6] เป็นคำตอบของกระบวนการสังเคราะห์แบบใหม่ที่พัฒนาขึ้น โดยคำนึงถึงความจำเป็นของการใช้น้ำกับตัวทำละลายอินทรีย์ ซึ่งมีความหมายต่อการแยกสารระหว่างสารอินทรีย์เคมีที่ละลายและไม่ละลายในชั้นน้ำ เช่นเดียวกับความจำเป็นในกระบวนการทำให้บริสุทธิ์ที่ต้องคำนึงถึงปัญหาสภาวะแวดล้อมด้วย นอกจากนี้ มีการศึกษาวิจัยการใช้พลังงานทางเลือกเพื่อเพิ่มประสิทธิภาพของกระบวนการต่างๆ และลดผลกระทบที่มีต่อสิ่งแวดล้อม ซึ่งเป็นไปตามหลักการของ “เคมีสีเขียว” ข้อที่ 9 การเพิ่มประสิทธิภาพของการใช้พลังงาน (Increase energy efficiency) เช่นการทำปฏิกิริยาที่อุณหภูมิปกติ แต่ภายใต้สภาวะความดันสูงจะช่วยทำให้ปฏิกิริยามีประสิทธิภาพมากขึ้น การนำพลังงานไมโครเวฟมาใช้ ถือเป็นทางเลือกใหม่ [7] ที่เพิ่มประสิทธิภาพในการทำปฏิกิริยาทางเคมีต่างๆที่รวมถึงการสร้างพันธะ ระหว่างคาร์บอนกับคาร์บอน [8,9] หรือคาร์บอนกับเฮเทอโรอะตอมต่างๆ เช่น ไนโตรเจน [10] หรือออกซิเจน [11] ประโยชน์ของการนำพลังงานไมโครเวฟมาใช้ในปฏิกิริยาทางเคมี ช่วยทำให้เกิดความเชื่อมโยงของเคมีแนวใหม่กับพลังงานที่สะอาด นอกจากนี้พลังงานไมโครเวฟสามารถช่วยย่นระยะเวลาในการทำปฏิกิริยาให้สั้นกว่าการใช้พลังงานแบบเดิม ถือเป็นการลดภาระการใช้พลังงานอย่างสิ้นเปลื้อง การเลือกใช้ตัวทำละลายในปฏิกิริยาที่ใช้พลังงานไมโครเวฟเป็นอีกวิธีที่สอดคล้องกับหลักการของ “เคมีสีเขียว” ตัวทำละลายที่ใช้ในปฏิกิริยาไมโครเวฟส่วนใหญ่จัดอยู่ในกลุ่มที่ถูกแนะนำให้ใช้ Preferred และ กลุ่มที่สามารถใช้ได้ Usable โดยมีการดูดกลืนพลังงานไมโครเวฟที่แตกต่างกัน การเลือกใช้ตัวทำละลายในปฏิกิริยาไมโครเวฟในแต่ละปฏิกิริยาจึงควรพิจารณาจากค่าการดูดกลืนพลังงาน (Tan δ ) และกลุ่มของตัวทำละลายสีเขียว Table 2. คุณสมบัติการดูดกลืนพลังงานไมโครเวฟของตัวทำละลายสีเขียว [7]
|
 Center of Excellence on Environmental Health and Toxicology (EHT)
Center of Excellence on Environmental Health and Toxicology (EHT)