|
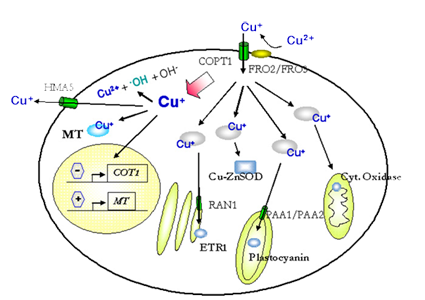
สังคมมนุษย์ในปัจจุบันได้นำโลหะชนิดต่างๆ มาใช้ประโยชน์ในชีวิตประจำวันเป็นจำนวนมาก บ้างนำมาเป็นวัสดุ บ้างนำมาเป็นส่วนประกอบของอุปกรณ์ไฟฟ้าอิเล็กทรอนิกส์ คุณทราบหรือไม่ว่าแร่ธาตุโลหะหลายชนิดก็มีความสำคัญต่อการดำรงชีพของสิ่งมีชีวิตเช่นกัน? ในทางชีววิทยาเราอาจแบ่งกลุ่มของโลหะออกเป็นสองประเภทใหญ่ๆ ได้แก่ กลุ่มที่จำเป็นต่อการเจริญเติบโตและพัฒนาของสิ่งมีชีวิต เช่น ธาตุเหล็ก ทองแดง และสังกะสี ซึ่งเป็นองค์ประกอบสำคัญของโปรตีนและเอนไซม์หลายประเภท สิ่งมีชีวิตจำเป็นต้องบริโภคโลหะเหล่านี้ในสัดส่วนที่เพียงพอต่อร่างกาย ส่วนโลหะกลุ่มที่สอง เช่น ตะกั่ว แคดเมียม ปรอท และสารหนู นั้นไม่มีความจำเป็นต่อการดำรงชีพของสิ่งมีชีวิต แต่มักเข้าสู่สิ่งมีชีวิตพร้อมกับโลหะที่จำเป็นอื่นๆ โดยเฉพาะอย่างยิ่งเมื่อสิ่งแวดล้อมมีระดับการปนเปื้อนของโลหะเหล่านี้สูง โลหะทั้งสองกลุ่มอาจก่อให้เกิดพิษต่อสิ่งมีชีวิตได้หากสะสมในปริมาณมาก ความเป็นพิษของโลหะ1มักเกิดจากการที่โลหะไปยับยั้งการทำงานของโปรตีนและเอ็นไซม์สำคัญต่างๆ หรือไปกระตุ้นให้เกิดอนุมูลอิสระภายในเซลล์ ซึ่งอนุมูลอิสระเหล่านี้จะมีฤทธิ์ทำลายสารอินทรีย์ที่เป็นโครงสร้างสำคัญของเซลล์ เช่น DNA หรือเยื่อหุ้มเซลล์ ความผิดปกติในสิ่งมีชีวิตที่เกิดจากพิษของสารโลหะอาจมีลักษณะแตกต่างกันตามแต่ชนิดของสิ่งมีชีวิต ความเข้มข้น และประเภทของโลหะ ตัวอย่างเช่น พิษของแคดเมียมในมนุษย์ทำให้เกิดลักษณะวงสีเหลืองที่โคนของซี่ฟัน อาการปวดกระดูก สูญเสียประสาทการดมกลิ่น ไตวาย และโลหิตจาง เป็นต้น (Godt et al. 2006) ในปัจจุบันพื้นที่ส่วนใหญ่ของประเทศไทยยังไม่ประสบปัญหามลพิษจากโลหะ แต่ในบางพื้นที่ปัญหานี้อาจจัดอยู่ในเกณฑ์ต้องเฝ้าระวังถึงระดับวิกฤตได้ ตัวอย่างเช่น ในรายงานสถานการณ์คุณภาพสิ่งแวดล้อมทางทะเล ปี พ.ศ. 2549 (โครงการติดตามตรวจสอบคุณภาพน้ำทะเล, กรมควบคุมมลพิษ) พบว่า คุณภาพน้ำทะเลของอ่าวไทยตอนในที่หลายจุดสำรวจมีระดับของสารหนู ทองแดง เหล็ก แมงกานีส ตะกั่ว และสังกะสี ในปริมาณที่สูงเกินกว่าค่ามาตรฐาน โดยเฉพาะธาตุเหล็กนั้นสูงกว่ามาตรฐานในเกือบทุกจุดสำรวจและในบางจุดมีระดับที่สูงเกินกว่าค่ามาตรฐานถึง 100 เท่า ดังนั้น ผู้ที่บริโภคสัตว์น้ำซึ่งจับได้จากบริเวณเหล่านี้จึงมีโอกาสได้รับสารโลหะบางชนิดเข้าสู่ร่างกายในปริมาณสูงไปด้วย แม้กระนั้นผู้บริโภคก็ยังไม่ควรตื่นตระหนกจนเกินไปจนถึงขั้นยกเลิกการบริโภคอาหารทะเล เนื่องจากโดยปกติสิ่งมีชีวิตมีความสามารถในการควบคุมความเข้มข้นของโลหะภายในร่างกายให้ไม่มากหรือน้อยเกินไปอยู่แล้ว และในกรณีที่ได้รับโลหะที่ไม่จำเป็นร่างกายก็มีกลไกในการลดพิษหรือขับสารโลหะออกจากร่างกาย ดังนั้น การปนเปื้อนของโลหะในอาหารเพียงเล็กน้อยจึงไม่ก่อให้เกิดอันตรายต่อผู้บริโภค ยกเว้นในกรณีของผู้มีความผิดปกติทางพันธุกรรมบางกลุ่มที่ร่างกายสูญเสียความสามารถในการป้องกันพิษจากโลหะ ผู้ที่มีความผิดปกติเหล่านี้ควรเพิ่มความระมัดระวังในการบริโภคอาหารและน้ำที่ปนเปื้อนโลหะหนักเป็นพิเศษ (Bertini & Rosato 2008; Schilsky 2009b) การศึกษาที่ผ่านมา ในยีสต์ สัตว์ และพืชต้นแบบ พบยีนจำนวนมากที่ทำหน้าที่ควบคุมมิให้ความเข้มข้นของโลหะธาตุใดธาตุหนึ่งภายในเซลล์มีระดับสูงเกินควร (ภาพที่ 1) โดยเมื่อเซลล์ตรวจพบการสะสมของโลหะ ก็จะลดการแสดงออกของยีนที่ช่วยในการนำธาตุโลหะนั้นเข้าสู่เซลล์ ในการขจัดโลหะที่มีปริมาณระดับป็นพิษนั้น สิ่งมีชีวิตอาจขับโลหะออกนอกเซลล์ผ่านทางกระบวนการขนส่งบนเยื่อหุ้มเซลล์ (plasma membrane efflux transporter) หรือเก็บกักไว้ภายในแวคิวโอล (vacuole) ซึ่งมีหน้าที่ในการเก็บของเสียภายในเซลล์ นอกจากนี้ เซลล์ยังสามารถสังเคราะห์สารประกอบอินทรีย์น้ำหนักต่ำและโปรตีนบางชนิดเพื่อจับกับไอออนของโลหะอิสระที่อยู่ในไซโทพลาซึม (cytoplasm) ได้อีกด้วย โดยโปรตีนประเภทที่พบบ่อยในเซลล์ของสิ่งมีชีวิตจำพวกยูแคริโอต (eukaryote) ได้แก่ เมทัลโลไธออนีน (metallothionein) และไฟโทคีเลติน (phytochelatin) (Grotz & Guerinot 2006) ภาพที่ 1 กระบวนการขนส่ง การรักษาสมดุล และการลดพิษของธาตุทองแดงภายในเซลล์พืช
เมทัลโลไธออนีนจัดอยู่ในกลุ่มของโปรตีนขนาดเล็กที่มีองค์ประกอบของกรดอะมิโนซิสเทอีน (cysteine) ปริมาณสูง และสามารถจับกับโลหะหนักได้หลายประเภท เมทัลโลไธออนีนแบ่งออกเป็น 3 กลุ่ม โดยกลุ่มที่ 3 (class III) อาจเรียกได้อีกชื่อหนึ่งว่าไฟโทคีเลติน ซึ่งแตกต่างจากกลุ่มที่ 1 และ 2 (class I and II) ตรงที่ไฟโทคีเลตินถูกสังเคราะห์จากกลูทาไธโอน (glutathione) ด้วยเอนไซม์ไฟโทคีเลตินซินเทส (phytochelatin synthase) และไฟโทคีเลตินมีโครงสร้างทั่วไปเป็น (?-Glu-Cys)2-11-Gly ่างจากโปรตีนที่ได้จากการสังเคราะห์โดยไรโบโซม (ribosome) จากการศึกษาถึงปัจจุบันพบไฟโทคีเลตินในสิ่งมีชีวิตบางกลุ่มเท่านั้น ได้แก่ พืชส่วนใหญ่ สัตว์ชั้นต่ำและยีสต์บางชนิด ขณะที่เมทัลโลไธออนีนนั้น พบได้ทั่วไปทั้งในสิ่งมีชีวิตกลุ่มยูแคริโอตและในแบคทีเรียบางสายพันธุ์ (Cobbett & Goldsbrough 2002) เมทัลโลไธออนีนและไฟโทคีเลตินมีหน้าที่สำคัญในการลดพิษจากโลหะหนัก หลักฐานจากการศึกษาในพืช Arabidopsis thaliana และยีสต์ Schizosaccharomyces pombe กลายพันธุ์ที่สูญเสียความสามารถในการสังเคราะห์ไฟโทคีเลติน แสดงให้เห็นว่า ไฟโทคีเลตินมีบทบาทสำคัญในการลดพิษจากแคดเมียม (Howden et al. 1995; Ha et al. 1999) ในขณะที่หนูซึ่งขาดยีนสร้างเมทัลโลไธออนีนกลุ่มที่ 1 และยีสต์ Saccharomyces cerevisiae ซึ่งขาดเมทัลโลไธออนีนกลุ่มที่ 2 จะสูญเสียความสามารถในการต้านทานพิษจากแคดเมียมและทองแดงตามลำดับ (Hamer, Thiele & Lemontt 1985; Masters et al. 1994) การทดลองเหล่านี้แสดงให้เห็นถึงความสำคัญของยีนที่ช่วยในการลดพิษจากโลหะ นอกจากนี้ความเข้าใจถึงกระบวนการสะสมและการลดพิษจากโลหะยังสามารถนำมาประยุกต์ใช้รักษาผู้ป่วยที่มีความผิดปกติทางพันธุกรรมซึ่งอาจได้รับอันตรายจากโลหะแม้เข้าสู่ร่างกายในปริมาณเพียงเล็กน้อยได้ เ ช่น ในการรักษาผู้ป่วยโรควิลสัน (Wilson’s disease) ซึ่งไวต่อการรับพิษจากทองแดง ผู้ป่วยต้องรับประทานธาตุสังกะสีเสริมในปริมาณที่สามารถเพิ่มการแสดงออกของยีนเมทัลโลไธออนีน เพื่อที่โปรตีนเมทัลโลไธออนีนจะช่วยลดพิษจากการดูดซึมธาตุทองแดงในเซลล์ร่างกายของผู้ป่วย (Schilsky 2009a) ในอนาคตเรายังอาจใช้องค์ความรู้เหล่านี้ ผนวกกับเทคโนโลยีชีวภาพเพื่อปรับปรุงสายพันธุ์ให้พืชหรือสัตว์ลดอัตราการสะสมของโลหะที่เป็นพิษได้ ซึ่งจะนำไปสู่การพัฒนาให้อาหารมีความปลอดภัยสำหรับผู้บริโภคสูงขึ้น รายการอ้างอิง
|
 Center of Excellence on Environmental Health and Toxicology (EHT)
Center of Excellence on Environmental Health and Toxicology (EHT)